Malattie autoinfiammatorie rare e potenzialmente letali : uno studio di Fase III della durata di un anno conferma l’efficacia di un farmaco per una remissione a lungo termine
Nuovi risultati di uno studio di Fase III, della durata di un anno, hanno confermato che la terapia biologica canakinumab ha prodotto una rapida e sostenuta remissione dei sintomi nella maggior parte dei bambini e degli adulti colpiti da un gruppo di malattie autoinfiammatorie rare e potenzialmente letali, denominate sindromi periodiche associate alla criopirina (CAPS).
Lo studio ha dimostrato che più del 90% dei pazienti affetti da CAPS trattati con canakinumab (28 su 31) è rimasto in remissione alla fine della fase finale di quattro mesi dello studio. Questo risultato ha avvalorato i dati ad interim derivati da fasi precedenti, che hanno dimostrato l’efficacia nel 97-100% dei pazienti. I risultati completi sono stati ora pubblicati sul New England Journal of Medicine.
“Questo studio rappresenta un importante passo avanti per la comunità delle malattie rare, perché canakinumab tratta le cause che stanno alla base delle CAPS, anziché limitarsi ai sintomi – spiega Helen J. Lachmann, medico dello UK National Amyloidosis Centre presso la Royal Free and University College Medical School a Londra, Regno Unito. – Nello studio i pazienti hanno conseguito un beneficio entro alcune ore dalla somministrazione di una dose singola di canakinumab e hanno necessitato di ulteriore trattamento solo ogni due mesi, per controllare i sintomi. Questo potrebbe offrire a canakinumab un vantaggio significativo rispetto alle terapie attuali, in un’area di esigenza medica non soddisfatta”.
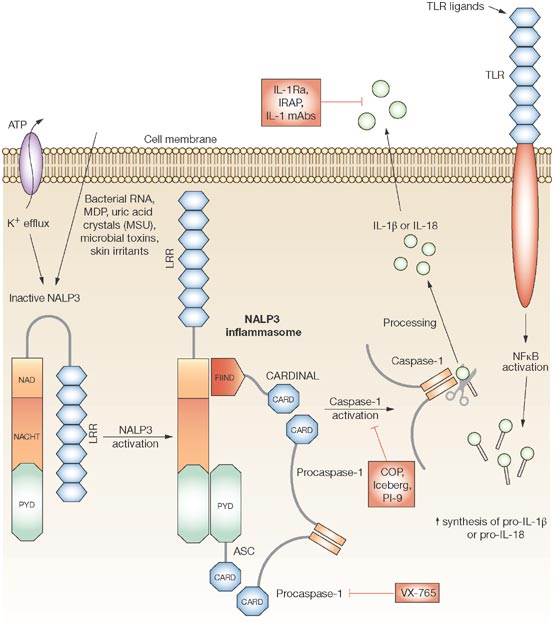
Le CAPS comprendono una serie di malattie rare che durano tutta la vita, associate a una mutazione genetica e caratterizzate dalla sovrapproduzione di interleuchina 1-β (IL‑1β), una proteina (o citochina) che svolge un ruolo cardine nel determinare l’infiammazione e la distruzione dei tessuti. I benefici clinici di canakinumab, un anticorpo monoclonale completamente umano noto in precedenza come ACZ885, sono dovuti al blocco selettivo e duraturo dell’IL-1β. Neutralizzando l’IL-1β per un periodo sostenuto, canakinumab “disattiva” tutti i sintomi dell’infiammazione nelle CAPS, come dimostrato in una nuova ricerca pubblicata su The Journal of Experimental Medicine.
Il successo di canakinumab nel trattamento delle CAPS ha fatto sì che la sua efficacia fosse investigata anche in altre malattie rare, quali l’artrite idiopatica giovanile sistemica (AIGS), o più comuni quali la gotta, la broncopneumopatia cronica ostruttiva (BPCO), l’artrite reumatoide e il diabete di tipo 2.
La strategia di ricerca e sviluppo di Novartis per ILARIS comporta l’uso di studi proof-of-concept, che sono studi clinici di Fase I su piccola scala in malattie geneticamente ben definite, per determinare come i geni interagiscono nelle vie molecolari o “di segnalazione”. I dati clinici e sui marcatori biologici che ne derivano sono poi sottoposti a modellazione e simulazione d’avanguardia, per produrre nuovi elementi di conoscenza sulla regolazione dell’IL-1ß nei pazienti. “La dimostrazione dell’efficacia del canakinumab è una notizia particolarmente importante – dichiara il Dott. Marco Gattorno, pediatra reumatologo presso l’ospedale Gaslini di Genova – e ci auguriamo di poterlo avere presto a disposizione anche in Italia per i nostri pazienti affetti da CAPS, che al momento dispongono di possibilità terapeutiche molto limitate ed invasive. Le CAPS sono un gruppo di malattie autoinfiammatorie molto rare e difficili da diagnosticare; ecco perché spesso i pazienti arrivano all’osservazione dei Centri Specializzati quando la patologia è in fase avanzata. A questo scopo stiamo attualmente coordinando un Registro europeo di pazienti affetti da malattie autoinfiammatorie, che ha l’obiettivo di sensibilizzare i pediatri al rapido riconoscimento di queste patologie, di mappare tutti i pazienti di queste rare patologie ed elaborare linee guida comuni per il trattamento terapeutico. Presso la UO Pediatria II dell’Istituto Gaslini di Genova diretta dal Prof. Alberto Martini opera il centro di riferimento italiano ed europeo per la diagnosi e il trattamento delle malattie autoinfiammatorie in età pediatrica”. Le CAPS comprendono tre sindromi di crescente gravità: sindrome autoinfiammatoria familiare da freddo (FCAS), sindrome di Muckle-Wells (MWS) e malattia infiammatoria multisistemica ad esordio neonatale (NOMID). I pazienti con CAPS manifestano affaticamento debilitante, febbre e anemia cronica sin dalla prima infanzia. L’infiammazione può colpire la cute, gli occhi e le ossa, causando rash, congiuntivite e artrite distruttiva. Altre complicanze gravi delle CAPS comprendono perdita progressiva dell’udito, compromissione della funzione visiva e intellettiva e amiloidosi, una malattia in cui l’accumulo di proteine può causare l’insufficienza funzionale di organi vitali. Circa il 25% dei pazienti affetti da CAPS sviluppa amiloidosi sistemica, che provoca insufficienza renale e di solito il decesso entro cinque-dieci anni. Lo studio clinico di Fase III nelle CAPS è stato uno studio multinazionale, randomizzato, in doppio cieco e controllato verso placebo, ideato per valutare l’efficacia, la sicurezza e la tollerabilità di ILARIS. Lo studio di 48 settimane ha coinvolto 35 pazienti, di età compresa tra nove e 75 anni, ed è stato suddiviso in tre parti. I primi risultati ad interim sono stati presentati al congresso dell’American Rheumatology College nell’ottobre 2008, mentre i risultati completi a un anno vengono ora pubblicati per la prima volta sul New England Journal of Medicine.
Nella prima parte dello studio, della durata di otto settimane, 35 pazienti sono stati trattati con una dose singola di (150 mg per iniezione sottocutanea). Tutti i pazienti eccetto uno (97%) hanno evidenziato una risposta rapida e completa1. Successivamente, 31 pazienti che hanno mantenuto la risposta sono passati alla seconda parte dello studio, una fase randomizzata, con canakinumab, di 24 settimane, in doppio cieco, controllata verso placebo. I pazienti sono stati trattati ogni otto settimane con o con placebo e, in caso di comparsa di recidiva, sono entrati nella terza parte.
La seconda parte dello studio comprendeva l’endpoint primario, un confronto tra il numero di pazienti trattati ogni otto settimane con ILARIS in cui si è verificata una recidiva della malattia o “riacutizzazione” rispetto ai pazienti trattati con placebo. I risultati hanno dimostrato che nessun paziente nel gruppo ILARIS ha manifestato una riacutizzazione della malattia, rispetto a 13 pazienti su 16 nel gruppo placebo (0% vs. 81%, p<0,001).
Dopo il completamento della seconda parte o la comparsa di una riacutizzazione della malattia, i pazienti hanno proseguito con la terza parte, che prevedeva almeno altre due dosi di Canakinumab per un minimo di 16 settimane. Dei 31 pazienti entrati nella terza parte, 28 hanno completato questa fase dello studio senza manifestare recidive (90%). In un paziente è comparsa una recidiva l’ultimo giorno dello studio, ossia 62 giorni dopo la somministrazione dell’ultima dose del farmaco . Inoltre, un paziente ha interrotto lo studio a causa di una percepita assenza di risposta terapeutica, mentre un altro ha interrotto lo studio per un’infezione del tratto urinario.
Canakinumab è stato generalmente ben tollerato, senza una consistente tipologia di eventi avversi, al di là di un aumento di tutte le infezioni sospettate. In due pazienti sono comparsi eventi avversi seri, ma non vi sono stati decessi né eventi avversi potenzialmente letali durante lo studio.
Canakinumab ha lo status di farmaco orfano nell’UE, negli USA, in Svizzera e in Australia per il trattamento delle CAPS ed è attualmente sottoposto a revisione prioritaria da parte delle autorità regolatorie negli USA, in Svizzera e in Australia. La revisione regolatoria è in corso anche nell’UE. I farmaci orfani sono quelli studiati per trattare malattie gravi o potenzialmente letali che colpiscono meno di 200.000 persone (negli USA) o meno di cinque persone su 10.000 (nell’UE). A ILARIS è stato concesso inoltre lo status di farmaco orfano per l’AIGS nell’UE, in Svizzera e negli USA.